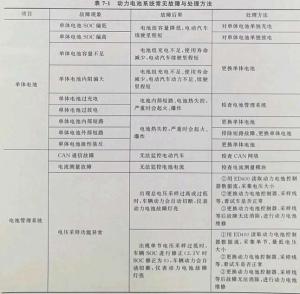
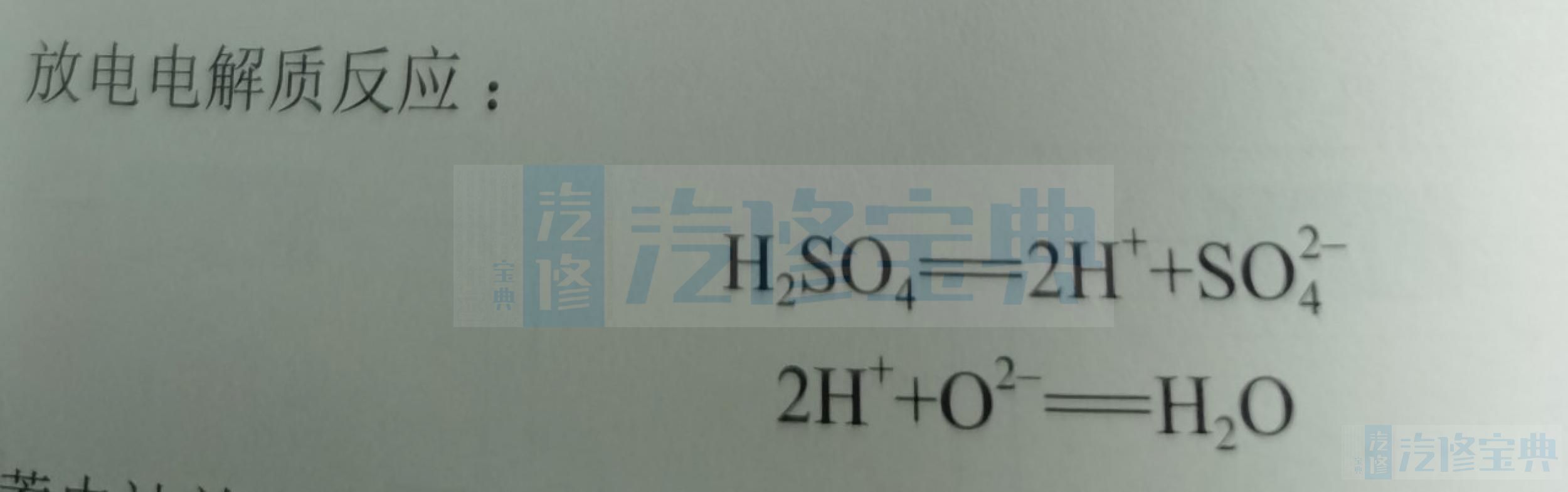电池:本质上是实现不同形式的能量(化学能、太阳能、微生物能等)与电能相互转换的装置。我们平时提到的电池一般指的是化学电池,即化学能和电能相互转换的装置,主要是通过氧化还原反应来实现能量转换的。
拓展:
氧化还原反应是三大基本化学反应之一,自然界中的燃烧、呼吸光合作用、化学电池、火箭发射等都与氧化还原反应息息相关。可以根据是否有氧化数的升降,或者是否有电子得失与转移来判断一个化学反应是否为氧化还原反应。发生氧化反应的物质称为还原剂,生成氧化产物;发生还原反应的物质称为氧化剂,生成还原产物。
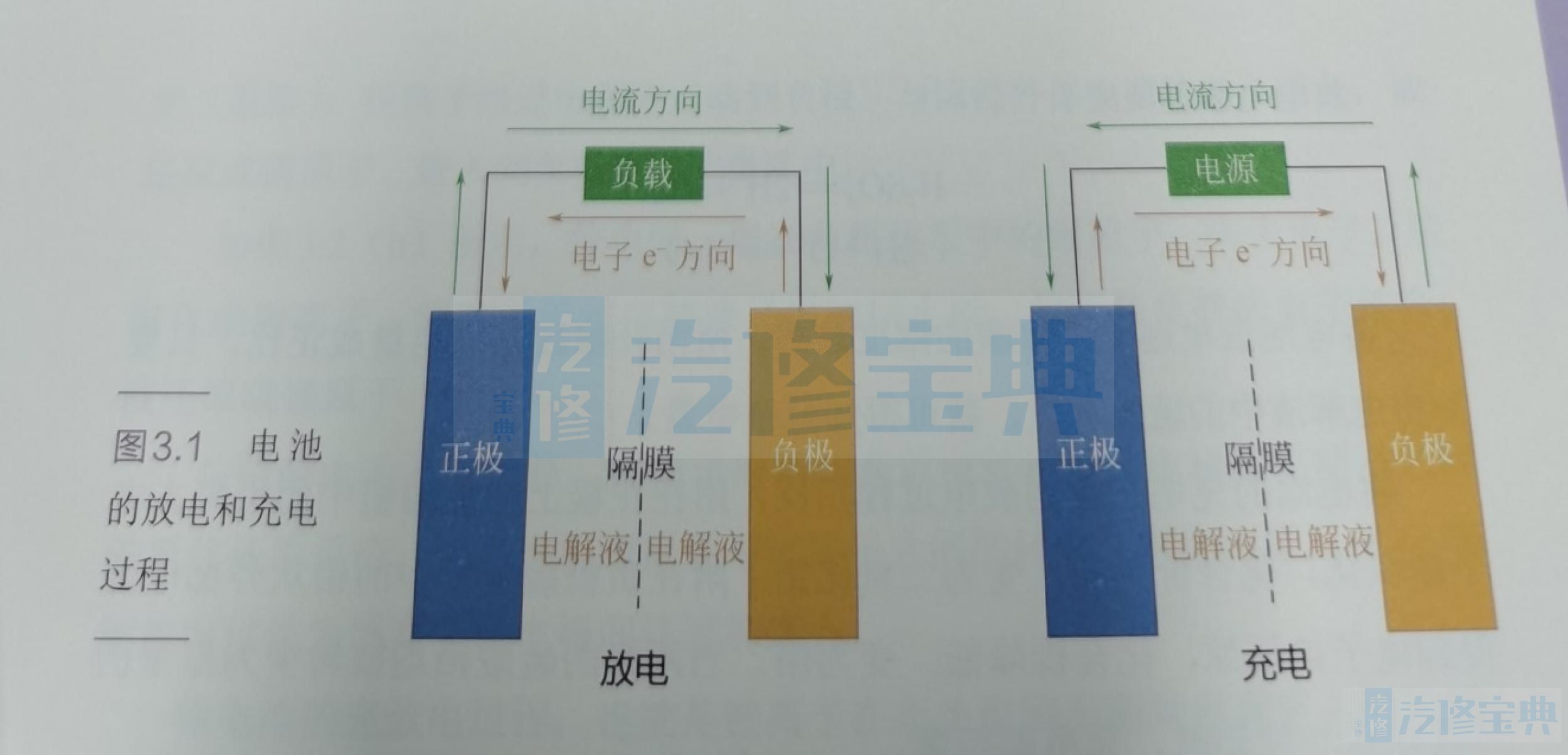
如图所示,电池自发地将本身的化学能转化为电能,称为电池的放电过程;而将外部电源供给的能量转变为电池反应产物的化学能,称为电池的充电过程。
电池一般由以下五个要素组成:
a.两种活泼性不同的金属(或另一种为非金属导体)构成正负电极。
b.电解质溶液。
c.形成闭合回路。
d.氧化还原反应能自发进行。
ε.为了防止正负两极接触而短路,一般会有隔膜将正负两极分隔开来。
正极、负极、电解液以及隔膜组成了电池的基本体系,放电时正极得到电子,发生还原反应:而负极失去电子,发生氧化反应,充电时过程与之这里分别用汽车常用的12V蓄电池和高压动力电池举例。
(1)蓄电池的电化学反应:
汽车用蓄电池也叫铅酸电池,它是汽车应用历史最长,也是最成熟的电池。其正极为二氧化铅(PbO2),负极为海绵状的纯铅,电解质为硫酸水溶液。
放电时,正极从外部负载得到电子,二氧化铅中的4价铅被还原为2价铅,并与电解液中的硫酸根结合生成硫酸铅:负极失去电子流入外部负载,纯铅被氧化为2价铅,并与电解液中的硫酸根结合也生成硫酸铅;同时,正极二氧化铅的氧离子与电解液中的氢离子结合生成水。
蓄电池放电越久,硫酸的浓度愈稀,所消耗硫酸与放电量成正比,只要测得电解液中的硫酸浓度,就可得知残余电量。
蓄电池的充电过程与放电过程相反,附在正极上的硫酸铅中的铅失去电子被氧化,化合价升高,变为二氧化铅;附在负极硫酸铅中的铅从外部电源得到电子被还原,化合价降低,变为铅。当两极的硫酸铅均被转变为原来的氧化铅和纯铅时,充电即结束。
总结下来,铅酸蓄电池的电化学反应方程式如下:
(2)动力电池的电化学反应:
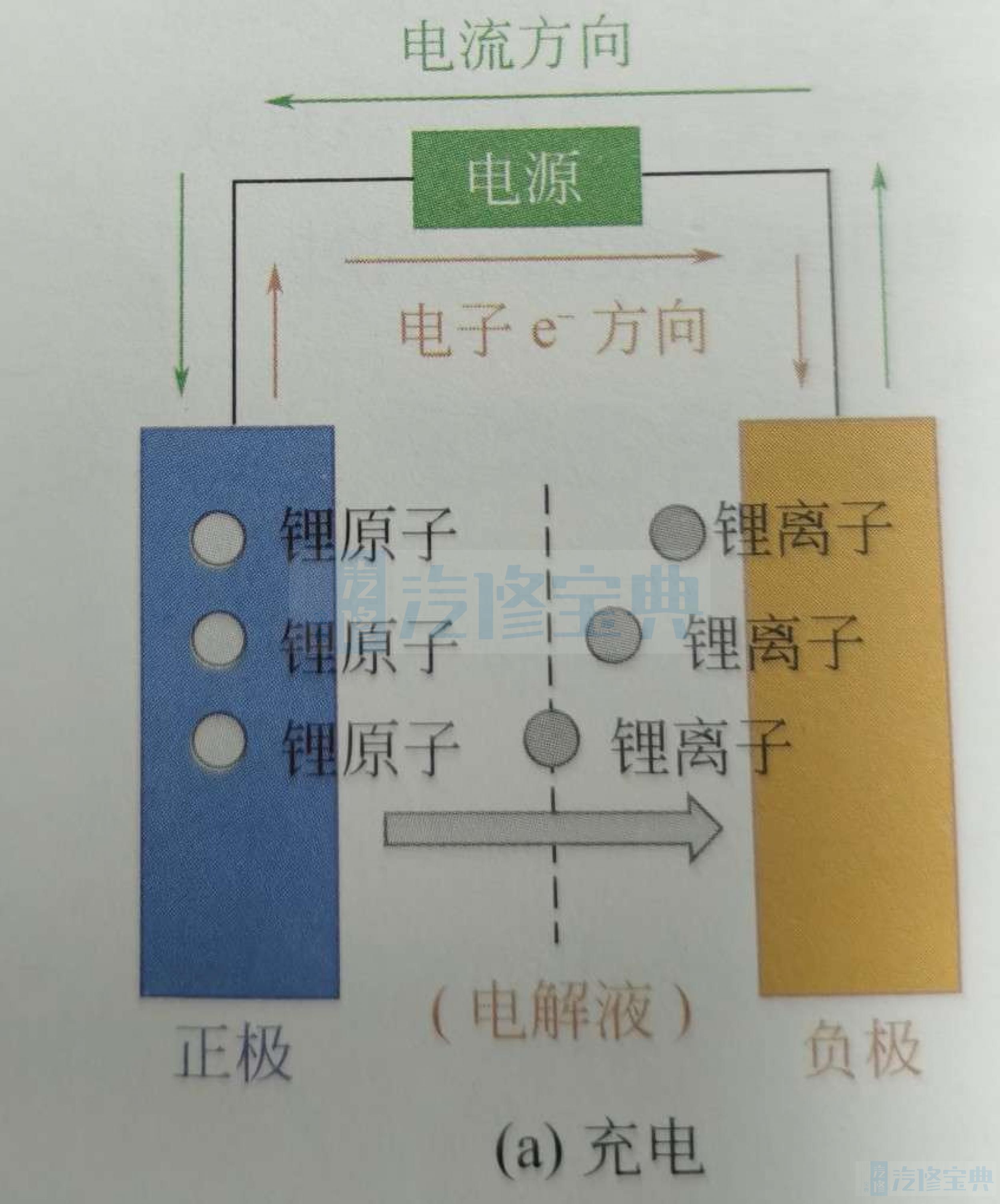
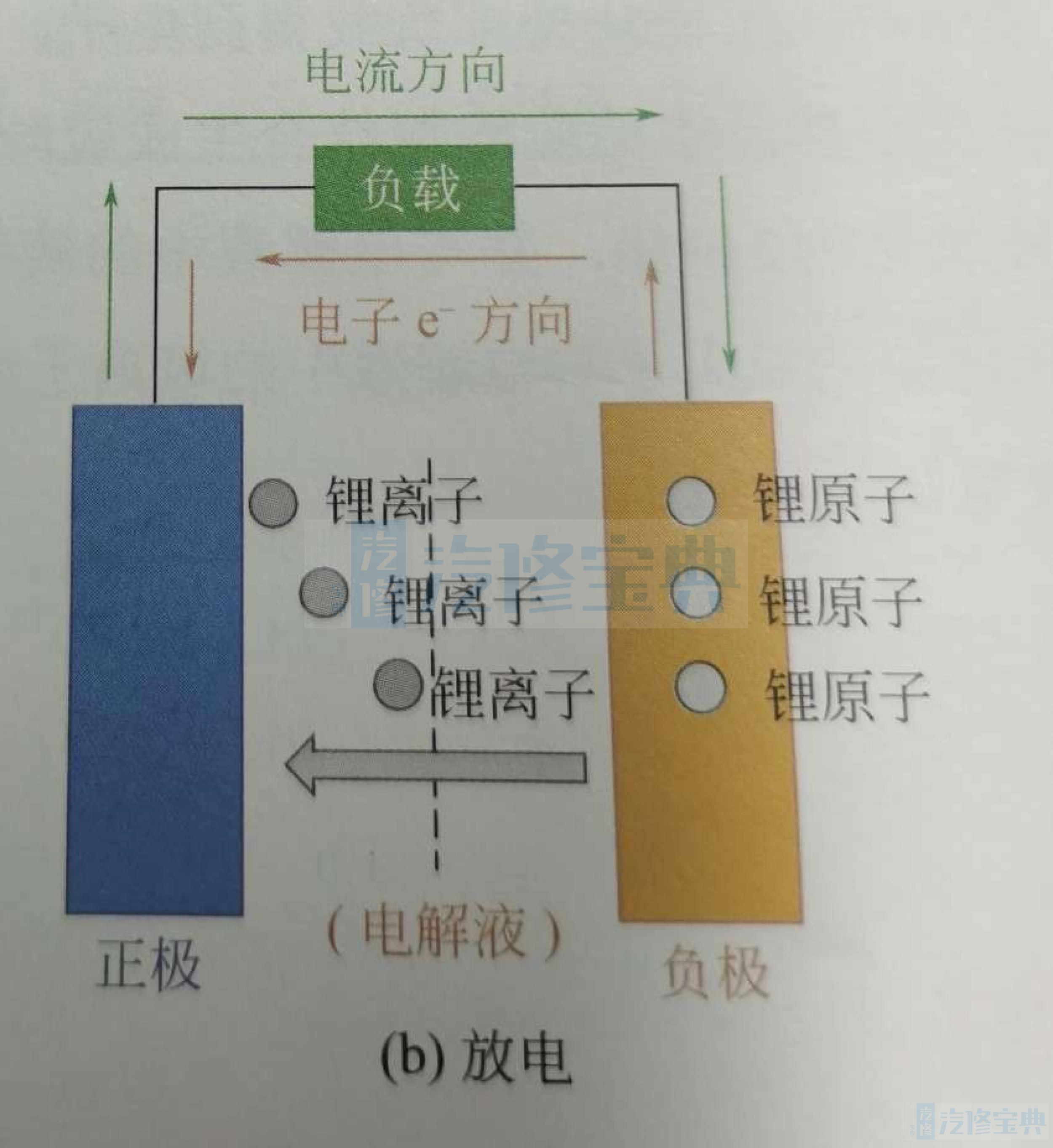
动力电池,也叫锂离子电池(简称锂电池),正极一般为含锂的化合物负极采用碳素材料,电解液使用非水液态有机电解质。
如图所示,充电时,正极上的锂原子失去电子,被氧化成锂离子(脱嵌),锂离子经过电解液运动到负极,与流经外部电源的电子结合,被还原成锂原子,嵌入到负极碳层的微孔中。
如图所示,放电时,嵌在负极碳层中的锂原子,失去电子,被氧化成锂离子,锂离子通过电解液又运动回正极,与流经负载的电子结合被还原成锂原子(嵌入)。
与铅酸电池不同的是,锂离子电池的充放电过程不是电极与电解液之间的氧化还原反应,而是电极锂原子与锂离子之间的转换(氧化还原反应),电解液仅仅作为锂离子在电极间往返的媒介。
锂电池的充放电过程,也就是锂离子在正负极间不断脱嵌和嵌入的过程同时伴随着等量电子的嵌入和脱嵌。锂离子数量越多,充放电的容量就越高。
(3)蓄电池和动力电池比较:
下表比较了铅酸蓄电池和锂离子动力电池的优缺点。